科目
内科
ポイント
- 脂質異常症は動脈硬化性疾患の重要なリスク因子の一つです。
- 脂質異常症は原発性高脂血症(遺伝的素因によるもの)と続発性高脂血症に分類されます。前者では家族性コレステロール血症、後者では甲状腺機能低下症を見逃さないことが重要です。
- 治療は患者様のリスクを評価して方針を決定します。生活習慣の改善を基礎として、必要な場合は積極的に薬物治療を検討します。
臨床的意義
- 動脈硬化性疾患を基盤として発症する心疾患、脳血管疾患は男女ともに日本人の死因の20%以上を占めています。近年の動脈硬化性疾患の増加の背景には、生活習慣の欧米化に伴う脂質異常症の増加があると考えられています。
- 動脈硬化性疾患のリスク因子としては、LDL-コレステロール(LDL-C)が特に重要です。LDL-Cの高値が心血管病を増やすことが多くの疫学研究で認められ、スタチンを中心としたLDL-Cの低下療法が心血管病を予防することが多くの臨床研究で証明されています。
- 脂質異常症を診断し、患者様のリスク評価を行い、適切に治療することは動脈硬化性疾患の発症・再発を予防するために重要です。
現状
-
- わが国では生活習慣の欧米化に伴い、脂質異常症の患者は年々、増加傾向にあります。厚生労働省が平成29年に実施した患者調査によると、わが国における脂質異常症の総患者数(継続的に医療を受けていると推測される患者数)は220万5,000人で、女性は男性の2.4倍でした(男性63万9,000人、女性156万5,000人)。また、推計患者数(調査日当日に、病院、一般診療所で受療した患者の推計数)は、外来14万8,000人、入院200人で、ほとんどの患者が通院治療を受けていました。
-
- 年齢とともに男女で総コレステロール値に変動が見られることが知られています。女性の場合は閉経前後から脂質異常症が増加し、高齢になるにつれ女性においても動脈硬化性疾患のリスクが高くなります。
- 現在、わが国の女性の冠動脈疾患発症率は欧米に比べて低いものの、食生活の欧米化や運動不足などによる動脈硬化性疾患の増加が懸念されます。治療にあたっては、家族性高コレステロール血症などの原発性脂質異常症と、甲状腺機能低下症、ネフローゼ症候群や糖尿病性・薬剤性などの続発性(二次性)脂質異常症との鑑別も重要です。
-
- 高齢者では成人に比べ動脈硬化性疾患の発症リスクが高く、脳血管障害、冠動脈疾患を発症したあとの予後も不良であるとともに要介護状態となるリスクも高いです。わが国では高齢者が要介護者となる原因の第2位は脳血管疾患(脳卒中)です(厚生労働省 平成28年国民生活基礎調査)。また、死因についても、65~84歳の高齢者において、心疾患が第2位、脳血管疾患が第3位であると推計されている(厚生労働省 平成30年人口動態統計月報年計(概数))。脂質異常症は糖尿病や高血圧、喫煙等と並び動脈硬化性疾患の主要なリスク因子です。
- 脂質異常症は高LDL-コレステロール血症、高トリグリセライド血症など血中脂質の異常をきたす生活習慣病であり、総コレステロール値、Non-HDLコレステロール値(総コレステロール値からHDLコレステロール値を引いた数値)、LDLコレステロール値が高くなれば、高齢者においても冠動脈疾患の発症リスクが増加するという様々な研究報告が得られています。
- 従って、動脈硬化性疾患の一次予防、二次予防に向けて脂質異常症を適切に管理することは極めて重要です。また、高齢者ではフレイルや甲状腺機能低下症などの合併による脂質異常症の発症リスクが高まります。
- 脂質異常症は痛みやかゆみなどの自覚症状がないために、患者が積極的に治療に取り組まない場合もあります。しかし、脂質異常症を放置すると、症状がないまま動脈硬化が進行して脳梗塞や弁狭窄などを発症し、生命の危険にさらされ、後遺症やQOLの低下のリスクが懸念されます。症状がないからそのままにしておくのではなく、進行を防ぐために適切な治療を続けることの重要性を患者様に伝え、治療の意義を理解してもらう必要があります。
診断
-
- LDL-C 140mg/dL以上:高LDLコレステロール血症
- LDL-C 120~139mg/dL:境界域高LDLコレステロール血症
- HDL-C 40mg/dL未満:低HDLコレステロール血症
- トリグリセライド(TG) 150mg/dL以上:高トリグリセライド血症
- 空腹時採血を原則とします。(10~12時間以上の絶食を空腹時とします。ただし、水やお茶などカロリーのない水分の摂取は可とします。)
- 脂質異常症の診断基準はスクリーニングのためのものであり、薬物治療を開始するための値ではありません。
- スクリーニングで境界域高コレステロール血症を示した場合は、高リスク病態がないか検討し、治療の必要性を考慮します。
- LDL-CはFriedewaldの式(TC-HDL-C-TG/5)を用いて算出します。(この式はTG<400mg/dLの場合に用いる)TG≧400mg/dL以上でFriedewaldの式を用いることができない場合や食後採血では、LDL-Cの代わりにnon HDL-C(TC-HDL-C)を用いて評価します。Non HDL-Cの基準はLDL-Cに30を加えた値とします。
病型診断
-
- 脂質は血液中ではアポ蛋白とともにリポ蛋白という粒子を形成して運搬されています。リポ蛋白は密度やサイズの違いにより、カイロミクロン、超低比重リポ蛋白(VLDL)、中間型リポ蛋白(IDL)、低比重リポ蛋白(LDL)、高比重リポ蛋白(HDL)の5種類に分画されます。脂質異常症ではどのリポ蛋白が増加または減少しているのかを考慮しながら診断・治療を進めることが大切です。
-
- 血中リポ蛋白代謝について説明します。カイロミクロンが小腸から、VLDLは肝臓から分泌されるトリグリセライド(TG)に富んだリポ蛋白です。リポ蛋白リパーゼ(LPL)はTG水解を行う酵素で、LPLを活性化する補酵素がアポC-Ⅱ、それを抑制するのがアポC-Ⅲです。LPLで代謝されたカイロミクロンはカイロミクロンレムナントとなり肝臓に取り込まれ、また、VLDLはIDLからLDLへと代謝され、末梢細胞にコレステロールを提供します。
- 余剰なLDLは酸化LDLなどに変化して血管壁に沈着して動脈硬化の原因となります。
- コレステロールを末梢細胞から引き抜き肝臓へ輸送する逆転送系が存在します。
- 小腸やカイロミクロンの代謝から作られた新生HDLは円盤状で扁平です。HDLは末梢細胞からAPT結合カセット輸送体1(ABCA1)というトランスポーターにより遊離コレステロール(FC)を引き抜きます。
- FCはレシチンコレステロールトランスフェラーゼ(LCAT)という酵素によりエステル化され、コレステロールエステル(CE)となり、HDL粒子の内部に蓄積されていき、球状のHDLとなっていきます。アポA-ⅠはLCATの補酵素として働きます。
- HDLはコレステロールエステル転送蛋白(CETP)によりCEをVLDL,IDL,LDLへ転送し、交換にTGがHDL側に転送されます。肝性リパーゼ(HTGL)はCETPの作用で増加したTGを水解して小さなサイズのHDLを再生し、コレステロールの末梢細胞からの引き抜きを促進する方向に働きます。
- LDLはLDL受容体(LDL-R)を介して肝臓に取り込まれ、また一部のHDLはHDL受容体(SP-BI)を介して肝臓に取り込まれ、末梢細胞の余剰なコレステロールが肝臓に逆転送されることになります。
- どのリポ蛋白が異常を示しているかは、血清脂質値からある程度は推察可能ですが、確認のためにはリポ蛋白分画検査(HPLC法または電気泳動法)が有用です。
留意すべき脂質異常症
-
- 脂質異常症は、その原因によって「原発性高脂血症」(遺伝的素因によるもの)と「二次性(続発性)高脂血症」の二つに分けられます。
- LDL-Cが高値になる疾患としては、前者では特に家族性高コレステロール血症(FH)は重要です。常染色体優性遺伝形式を示すFHは500人に1人の発症率で疾患頻度が高く、日本では25万人の患者様がいると推定されています。しかし、FHのうち、診断されている割合は1%未満と非常に少ないことが報告されており、その多くの症例が正確な診断を受けていません。FHの症例は高LDL-C血症に暴露されている時間が長く、通常のLDL-C血症に比べて10年以上も若年で冠動脈を発症するため、早期診断・早期治療が極めて重要です。
- FHの診断基準では、下記3項目の内2項目以上が認められた場合にFHと診断されます。
① 高LDL-C血症(未治療時のLDL-C 180mg/dL以上)
② 腱黄色腫(手背、肘、膝などの腱黄色腫あるいはアキレス腱肥厚)あるいは皮膚結節性黄色腫
③ FHあるいは早期冠動脈疾患の家族歴(2親等以内の血族) - 二次性高脂血症では、LDL-C高値を示す甲状腺機能低下症、TG高値を示すアルコール過剰摂取も頻度が高く注意が必要です。
リスク評価
動脈硬化性疾患には脂質異常症以外にも、高血圧・糖尿病などの併存する疾患、喫煙などの生活習慣、冠動脈疾患の家族歴などのリスク因子があり、それらの重複により危険性はさらに高くなります。このため、個々の症例ごとにリスク評価を行い、治療方針を決定する必要があります。
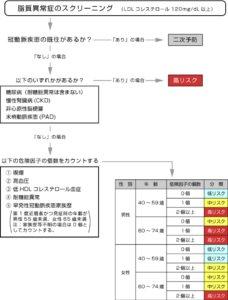
日本動脈硬化学会(編): 動脈硬化性疾患予防ガイドライン2017年版. 日本動脈硬化学会, 2017
- ステップ1としては、冠動脈疾患の既往の有無が重要で、既往がある場合は二次予防として最も高いリスク評価とします。
- ステップ2としては、一次予防における高リスク状態を検討し、①糖尿病、②慢性腎臓病(CKD)、③非心原性脳梗塞、④末梢動脈疾患(PAD)のいずれかがある場合は高リスクと評価します。
- ステップ3としては、その他の一次予防において、性別、年齢、喫煙、血清コレステロール、収縮期血圧から絶対リスク(10年間の冠動脈疾患による死亡率)を評価し、カテゴリーを求めます。
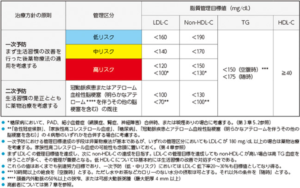
- 以上のカテゴリー分類に基づいて、個々人の脂質の管理目標値を以下の表に従って決定します。
日本動脈硬化学会(編): 動脈硬化性疾患予防ガイドライン2017年版. 日本動脈硬化学会, 2017
動脈硬化性疾患予防ガイドライン2022年版
- 一次予防における管理目標達成の手段は非薬物療法が基本ですが、低リスクにおいてもLDL-C≧180mg/dLの場合は薬物療法を考慮するとともに、家族性高コレステロール血症の可能性を念頭に置いておきます。
- まず、LDL-Cの管理目標値を達成し、その後non-HDLの達成を目指します。
- これらの値はあくまでも到達努力目標値であり、一次予防(低・中リスク)においてはLDL-C低下率20~30%、二次予防においてはLDL-C低下率50%以上も目標値となりえます。
生活習慣の改善
- 治療の基本は生活習慣の改善であり、禁煙をはじめとした生活指導と食事療法・運動療法を指導します。
- 禁煙し、受動喫煙を回避すること、過食と身体活動不足に注意し、適正な体重を維持すること、肉の脂身・動物脂・鶏卵・果糖を含む加工食品の大量摂取を控えること、魚・緑黄色野菜を含めた野菜・海藻・大豆製品・未精製穀類の摂取量を増やすこと、糖質含有量の少ない果物を適度に摂取すること、アルコールの過剰摂取を控えること、中等度以上の有酸素運動を、毎日合計30分以上を目標に実施することなどです。
- 食事指導としては、総エネルギー摂取量(kcal/日)は、一般に標準体重((身長m)²×22)kg×身体活動量(軽い労作で25~30、普通の労作で30~35、重い労作で35~)とします。脂質エネルギー比率を20~25%、飽和脂肪酸エネルギー比率を4.5%以上7%未満、コレステロール摂取量を200mg/日に未満に抑えること、n-3系多価不飽和脂肪酸の摂取を増やすこと、工業由来のトランス脂肪酸の摂取を控えること、炭水化物エネルギー比を50~60%とし、食物繊維の摂取量を増やすこと、食塩の摂取は6g/日未満を目標にすること、アルコールの摂取を25g/日以下に抑えることなども指導します。
- 運動療法は有酸素運動(ウォーキング、速歩、水泳、エアロビクスダンス、スロージョギング、サイクリング、ベンチステップ運動など)を中心に実施します。強度は中等度以上(通常速度のウォーキングに相当する運動強度。メッツ(METs)(安静時代謝の何倍に相当するかを示す活動強度の単位)では一般的に、3メッツ(歩行)ですが、個々人の体力により異なります。運動中の主観的強度としてボルグ・スケール11~13(楽である~ややきつい))を目標にします。毎日合計30分以上実施し、少なくとも週に3日は実施します。運動療法以外の時間もこまめに歩くなど、できるだけ座ったままの生活を避けます。
薬物療法
- 生活習慣の改善で脂質管理が不十分な場合は薬物療法を考慮します。脂質異常症治療薬としてはスタチン系薬、小腸コレステロールトランスポーター阻害薬、陰イオン交換膜樹脂、プロブコール、PCSK9阻害薬、MTP阻害薬、フィブラート系薬、選択的PPARαモジュレーター、ニコチン酸誘導体、n-3系多価不飽和脂肪酸の10つの種類があります。
- 脂質異常症治療で重要なのはLDLコレステロールの管理であり、薬物療法を行うに当たってはスタチンを第一選択薬として、必要に応じて他の薬剤の併用について考慮するのが基本です。その他、単剤療法では、小腸コレステロールトランスポーター阻害薬(エゼチミブ)、陰イオン交換樹脂(レジン)、スタチン不耐患者にはPCSK9阻害薬が考えられます。
- 前期高齢者(65歳以上74歳以下)においては、スタチン投与によって、冠動脈疾患、非心原性脳梗塞の一次および二次予防の両方で効果が期待できることが複数の研究から示されています。しかし、後期高齢者(75歳以上)においては、冠動脈疾患の二次予防効果を示す研究報告はありますが、一次予防の有効性を示す十分なエビデンスがないため、喫煙や食事などの患者の生活習慣や合併症を確認し他の動脈硬化性疾患のリスクの有無に応じて慎重に投薬を判断します。
- 閉経前女性のコレステロール値増加に対する治療は生活習慣改善を優先し、家族性高コレステロール血症などリスクの高い場合は薬物治療を行います。冠動脈疾患の生涯リスクを考慮して早期からの予防を検討します。
- 単剤で効果が不十分な場合には、増量または作用機序の異なる薬剤の併用を検討します。スタチン以外の薬剤についてはスタチンとの併用で主に用いられますが、慎重に投与を行う必要があります。併用する場合、スタチンとエゼチミブの組み合わせや合剤の利用はアドヒアランス向上につながる可能性がありますが、重篤な肝障害の患者様には禁忌となります。スタチンとフィブラート系薬剤を併用する場合は、両剤とも横紋筋融解症の発症リスクがあることから、特に腎機能低下リスクの高い高齢者では注意すします(これまで腎機能低下患者に対するスタチン系薬剤とフィブラート系薬剤の併用は添付文書で「原則禁忌」とされていましたが、海外の状況及び臨床現場の要望を踏まえ、平成30年10月、併用が可能な形に添付文書の改訂がなされました。)。
- 高齢の患者様は複数の疾患に罹患していることも多く、それぞれの併存疾患に対して投与された薬剤同士で薬物相互作用が起こりやすいため、それに起因する副作用の発現が懸念されます。高齢患者様ではスタチン投与で糖尿病の新規発症が有意に増加するため注意します。スタチン系薬は、CYP阻害薬との併用で血中濃度が増加する可能性があり、その有害作用に注意する必要があります。これまでにCYP代謝に影響する薬物とスタチンとの併用による横紋筋融解症の発症が多数報告されています。一方、リファンピシン、バルビツール酸などCYPを誘導する薬剤では逆に併用によってスタチンの効果が減弱する可能性があります。CYP以外でも、スタチンは乳癌耐性蛋白やOATP1B1等のトランスポーターの影響を受けます。乳がん耐性蛋白やOATP1B1を阻害するシクロスポリンは特にロスバスタチン、ピタバスタチンとの併用が禁忌です。